
Paneles NGS
SOPHIA Pan Myeloid Plus Solution
CARACTERÍSTICAS DEL TEST
Esta prueba incluye la identificación de los marcadores genéticos actuales (SNPs, indels, CNVs y reordenamientos) relacionados con las patologías mieloides.
ESTE TEST COMPRENDE
Un panel de secuenciación de ADN dirigida a 63 genes relevantes asociados a patología mieloide y síndromes mieloides hereditarios. El panel incluye 15 genes que se agregan para el estudio de variación en el número de copias (CNV) en regiones que dan información de del (5q), del (7q), del (20q), trisomía del 8, del (17p). Un panel de ARN que permite la detección de 119 genes de fusión, para la detección de translocaciones asociadas a patologías mieloides. El empleo de la tecnología de captura permite de forma fiable la detección de mutaciones en CEBPA, FLT3 y CALR incluyendo la detección de ITD (internal tandem duplications) y deleciones de gran tamaño. La cobertura del enriquecimiento que se realiza y la profundidad de secuenciación con MiSeq (Illumina) permiten identificar variantes con una frecuencia alélica a partir de un 5%.
El análisis incluye el estudio bioinformático e informe clínico con la descripción de las mutaciones, así como su interpretación y relevancia clínica: valor predictivo, pronóstico o potencialmente relevantes para la óptima toma de decisiones y hasta la inclusión en ensayos clínicos.
REQUISITOS DE LA MUESTRA
El estudio puede ser llevado a cabo en muestra de médula ósea o sangre periférica anticoagulada con EDTA.
REQUISITOS DE LA MUESTRA
El estudio se llevará a cabo en una muestra de sangre periférica anticoagulada con EDTA, de la que se extrae DNA.
–
–
–
–
Se aplica a enfermedades cardíacas de origen genético que afectan al miocardio o al ritmo cardíaco, así como malformaciones congénitas cardíacas y trastornos vasculares arteriales. Estas patologías se caracterizan por el riesgo de muerte súbita o morbilidad crónica, afectando al paciente y su familia. Esta área tiene un rol muy importante en medicina del deporte.
El siguiente documento descargable describe los genes estudiados para cada panel.
Microbiota y Microbioma
La microbiota es el conjunto de microorganismos: bacterias, virus, hongos, arqueas y protozoos—que colonizan diferentes partes del cuerpo humano, como la piel, el aparato digestivo, y el aparato genital. Colonizan nuestro organismo desde el vientre materno, pero fundamentalmente desde el momento del nacimiento, se va desarrollando a medida que avanza la vida, de forma que su composición es diferente en la infancia y adolescencia que en la vida adulta. Cada individuo tiene una microbiota específica que actúa como una tarjeta de identidad personal.
La mayor población de microorganismos en el cuerpo humano reside en el intestino y se conoce colectivamente como microbiota intestinal. Esta microbiota ayuda a digerir los alimentos, a defenderse de las enfermedades y al desarrollo neurológico. Esta comunidad puede llegar a superar las 1000 especies y pesar hasta 2 kg.
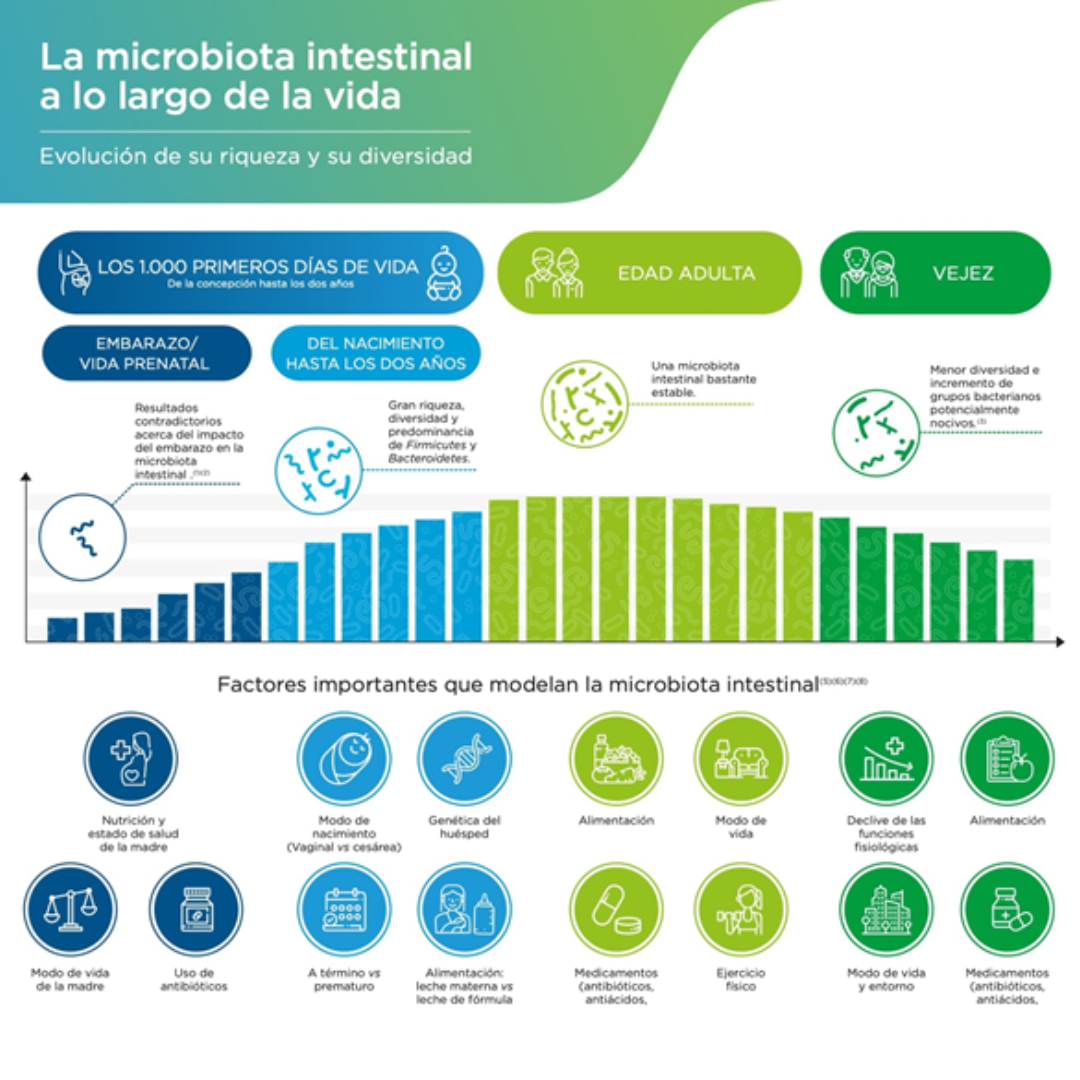
El microbioma, por su parte, es el conjunto de genes de estos microorganismos. El genoma humano consiste en aproximadamente 23,000 genes, mientras que nuestro microbioma codifica más de 3 millones de genes que producen miles de metabolitos (representan más del 99%). Es dinámico y juega un papel fundamental en la salud general del organismo.
Disbiosis
La relación de la microbiota y el organismo es simbiótica: mientras que las bacterias realizan una función protectora frente a enfermedades y agentes patógenos y de ayuda en la metabolización de los alimentos ingeridos, el organismo les ofrece un lugar donde vivir. Cuando la microbiota sufre alteraciones—por factores como mala alimentación, estrés, uso excesivo de antibiótico, etc—se produce disbiosis. Esta condición de desequilibrio microbiano crónico está asociado a la reducción de la diversidad y prominencia de cepas patogénicas pudiendo derivar en diversas enfermedades inflamatorias, autoinmunes, metabólicas y neoplásicas, además de algunos trastornos de la conducta. Por lo tanto, modular la microbiota intestinal surge como una forma potencial de abordar muchas enfermedades crónicas.
Panel de Microbioma por NGS
Ofrecemos un estudio completo del microbioma intestinal mediante secuenciación de nueva generación (NGS). Este análisis permite identificar y cuantificar los microorganismos presentes en el intestino, proporcionando información valiosa para la prevención y el tratamiento de diversas enfermedades.
¿Cómo puede el conocimiento de mi microbioma contribuir a mejorar mi calidad de vida?
Conocer tu microbioma puede tener un impacto significativo en tu salud y calidad de vida porque las alteraciones en la microbiota intestinal pueden estar vinculadas a diversos problemas de salud, desde los más evidentes, como malestares digestivos, hasta condiciones más complejas que afectan diferentes aspectos del bienestar, como la salud mental, la piel, y el metabolismo.
La microbiota intestinal desempeña un papel crucial en la regulación de muchas funciones biológicas. Si existe un desequilibrio en la composición de las bacterias, puede llevar a trastornos intestinales, inflamación crónica, enfermedades metabólicas, trastornos del ánimo como la depresión o ansiedad, y otras afecciones.
¿A quién está dirigido este estudio?
Si experimentas síntomas persistentes de malestar digestivo, problemas cutáneos, enfermedades metabólicas o trastornos hormonales como el síndrome de ovario poliquístico o dificultades para concebir, un análisis de microbioma puede ofrecerte información valiosa para abordar la causa subyacente de estos problemas. Además, si simplemente deseas mejorar tu salud intestinal y, con ello, tu calidad de vida, este estudio podría ser un paso esencial. Es fundamental recordar que estos estudios deben realizarse después de consultar a un médico y descartar otras posibles afecciones mediante estudios médicos previos.
¿Cómo se Realiza el Estudio?
Para analizar la microbiota intestinal se requiere una muestra de heces.
Solicitar recipiente en nuestro laboratorio y colocar una porción de materia fecal, luego entregar/enviar para su procesamiento.
Tiempo de Proceso: 30 días.
Los genes poseen básicamente dos regiones: los exones, que son aquellas regiones codificantes del gen cuya información será traducida en forma de proteínas, y los intrones, que son regiones del ADN que se encuentran entre los exones. También son importantes las regiones de los genes llamadas regulatorias, dado que estas secuencias regulan la fabricación de la proteína para la cual codifica ese gen.
El conjunto de todos los exones del genoma recibe el nombre de exoma. Si bien hoy se sabe que el exoma constituye aproximadamente un 1,5% del genoma, también se sabe que el 85% de las mutaciones causantes de enfermedades se encuentran allí.
El exoma clínico consiste en el estudio de todas las regiones codificantes y regulatorias de todos los genes con relevancia clínica demostrada en la literatura y en las bases de datos asociadas a enfermedades genéticas. Se recomienda para aquellas patologías en las cuales el fenotipo es muy complejo y resulta difícil tener una caracterización clínica orientativa de los genes a estudiar. También es muy utilizada en aquellos pacientes que fueron previamente estudiados por paneles de genes y que obtuvieron un resultado negativo. El análisis del exoma es actualmente la prueba más abarcativa para identificar mutaciones en una gran variedad de trastornos genéticos.
Es importante destacar que el análisis del exoma permite diagnosticar entre un 20% y 60% de los pacientes dependiendo del área de diagnóstico y de cada patología en particular, y este porcentaje aumenta considerablemente cuando existe una caracterización clínica exhaustiva por parte del profesional solicitante. En algunas oportunidades se analiza primero al paciente y luego, cuando se detecta una posible mutación causante de la enfermedad, se procede a estudiar a los padres para determinar el origen de la mutación identificada.
El estudio del exoma se sugiere para los siguientes cuadros clínicos:




